Matéria: tudo que tem massa e
ocupa lugar no espaço.
A rua, veículos, placas, fios,
postes, animais, plantas são constituídos de matéria. A matéria pode ser
visualizada ou apenas percebida pelos nossos sentidos, como o ar, vento que
percebemos pela sensação na pele nos cabelos.
SUBSTÂNCIA: diferentes tipos de
matéria. Ex. ouro, água, giz, barro,
MOLÉCULA: menor porção de uma
substância que tem as mesmas propriedades dessa substância As moléculas são
muito pequenas (microscópicas), essas moléculas são formadas por partículas
ainda menores ÁTOMOS
Ex: uma gota de água é formada
por muitas moléculas de água, representadas: H2O . Essa molécula é formada pelos átomos
hidrogênio (H) e oxigênio (O).
Os átomos (elementos químicos)
que constituem as moléculas, matéria são representados por símbolos e nomes que
seguem a seguinte regra.
Elementos podem ser representados
por uma letra ou duas letras do alfabeto:
Uma letra, sempre maiúscula: Ex:
Oxigênio – O , nitrogênio – N, enxofre – S, carbono – C, flúor – F ,....
Duas letras, a 1ª maiúscula e a
2ª minúscula. Ex: ferro – Fe, cálcio – Ca, magnésio – Mg, prata – Ag, ouro – Au, sódio – Na, ....
ESTADOS FÍSICOS DA MATÉRIA:
ESTADO SÓLIDO: Se caracteriza por
apresentar forma não varia e volume constante. Ex: gelo
ESTADO LÍQUIDO: Se caracteriza
por apresentar forma variável e volume constante. Ex: água.
ESTADO GASOSO: Se caracteriza por
apresentar forma e volume variáveis. Ex: vapor da água, gás oxigênio,....
MUDANÇAS DOS ESTADOS FÍSICOS DA
MATÉRIA.
Aumento da temperatura -
FUSÃO E VAPORIZAÇÃO. Abaixamento da temperatura – CONDENSAÇÃO E LIQUEFAÇÃO.
FUSÃO: transforma uma substância
sólida em líquida.
VAPORIZAÇÃO: transforma uma
substância líquida em gasosa (vapor). Tipos: - evaporação – lenta, roupa no varal,
... – ebulição – mais rápida, água fervendo na chaleira, ... – calefação bem rápida.
ÁTOMO: 500 anos antes de Cristo,
o filósofo grego Demócrito já afirmava que a matéria era formada por partículas
muito pequenas às quais chamou de átomos. Átomo em grego, quer dizer
indivisível.
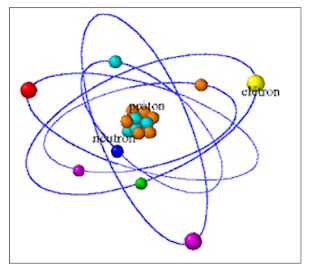
NÚCLEO E
ELETROSFERA:
NÚCLEO
- formado por dois tipos de partículas:
os prótons (p) de carga elétrica
positiva e nêutrons (n) sem carga elétrica,
a soma dessas partículas resulta na massa atômica (A)
ELETROSFERA
– “coroa” circunda o núcleo do átomo, constituída por partículas denominadas
elétrons (e) de carga elétrica
negativa.
Cargas de
mesmo sinal se repelem e de sinais contrários se atraem.
NÚMERO DE
MASSA E NÚMERO ATÔMICO.
NÚMERO DE
MASSA – A = SOMA DO NÚMERO DE PRÓTON E NÊUTRONS - A = p + n
NÚMERO ATÔMICO – Z = número de prótons - Z = p
Os elementos químicos conhecidos na natureza são
classificados em metais, semimetais, não metais e gases nobres
CARACTERÍSTICAS:
METAIS: - apresentam brilho quando polidos;
- sob temperatura
ambiente, apresentam-se sólidos, exceto o mercúrio que e líquido;
- conduzem bem
calo e eletricidade;
- são resistentes,
maleáveis e dúcteis;
- normalmente
apresentam 1,2 ou 3 elétrons na última camada o que torna possível sua
transformação em cátions, devido à perda de elétrons.
NÃO METAIS: - podem ser
encontrados nos estados sólido (I, S,P, C) , gasoso (N, O, F, .....) e um
líquido o bromo.
- não
apresentam brilho exceto o iodo e o carbono sob forma de diamante;
- não
conduzem bem calor e eletricidade, exceto o carbono sob forma de grafite;
-
possuem de 4 a 7 elétrons na última camada o que torna possível sua
transformação em ânions, no caso
de receber elétrons.
SEMIMETAIS: - tanto podem apresentar características de metais como de
não metais;
- o
silício tem brilho e não é maleável.
GASES NOBRES: - dificilmente se
combinam com outros elementos químicos;
-
são encontrados em pouca quantidade no ar.
HIDROGÊNIO: - possui propriedades, diferentes daquelas dos outros elementos,
é um grupo aparte;
- é
incolor, inodoro, combustível, sendo o elemento químico mais leve que se
conhece.
LIGAÇÕES QUÍMICAS
Ocorre com os elementos que tem a última camada eletrônica incompleta,
tendem a perder, ganhar ou compartilhar elétrons para ficarem estáveis com 8
elétrons na última camada.
A ligação química pode ser de três tipos: iônica, covalente ou
metálica.
LIGAÇÃO IÔNICA; ocorre entre metais e não metais - hidrogênio e metais. Ocorre a formação de
íons positivos e negativos. Ocorre a transferência de elétrons, um elemento o
metal perde elétrons e o não metal recebe elétrons.
LIGAÇÃO COVALENTE: ocorre não metais -
hidrogênio e não metais. Ocorre o compartilhamento de elétrons poisos
dois elementos têm a tendência de receber elétrons. Átomos unidos por ligações
covalentes formam moléculas, recebendo o nome de substâncias moleculares.
LIGAÇÃO METÁLICA: -acontece normalmente com átomos de metais – os
átomos se mantêm unidos numa disposição organizada por grande força de atração.
Formam ligas metálicas por exemplo o aço, o bronze, ...



Nenhum comentário:
Postar um comentário